5年生存率75%!

国立がん研究センター中央病院の後藤悌先生
その数字を見たときには目を疑った。 「5年生存率75%」 あるタイプの肺がんでは、ステージ4の患者さんの5年生存率が75%というのだ。がん全体の5年生存率60%台後半を超えている!
1年以上前の2018年8月、「ジャパンキャンサーフォーラム2018」(認定NPO法人キャンサーネットジャパン主催)でのことだ。 数字を掲げたのは、国立がん研究センター中央病院呼吸器内科の後藤悌(やすし)医師。後日、確認すると、治療効果の高かった患者さんを対象としたデータだという。それを踏まえて、後藤悌先生は、「率(%)よりも、実際に5年生きた患者さんがいたということが大切です」と述べた。
細かいタイプごとに治療法が違う
一口に肺がんといっても、細かく分類され、それぞれの治療法が異なる。 肺がんは大きく、小細胞肺がん、非小細胞肺がんに分かれる。小細胞肺がんが約15%、非小細胞肺がんが約85%だ。非小細胞肺がんの大半が腺がんで、ほかは扁平上皮がんや大細胞がんなどである(表1参照)。
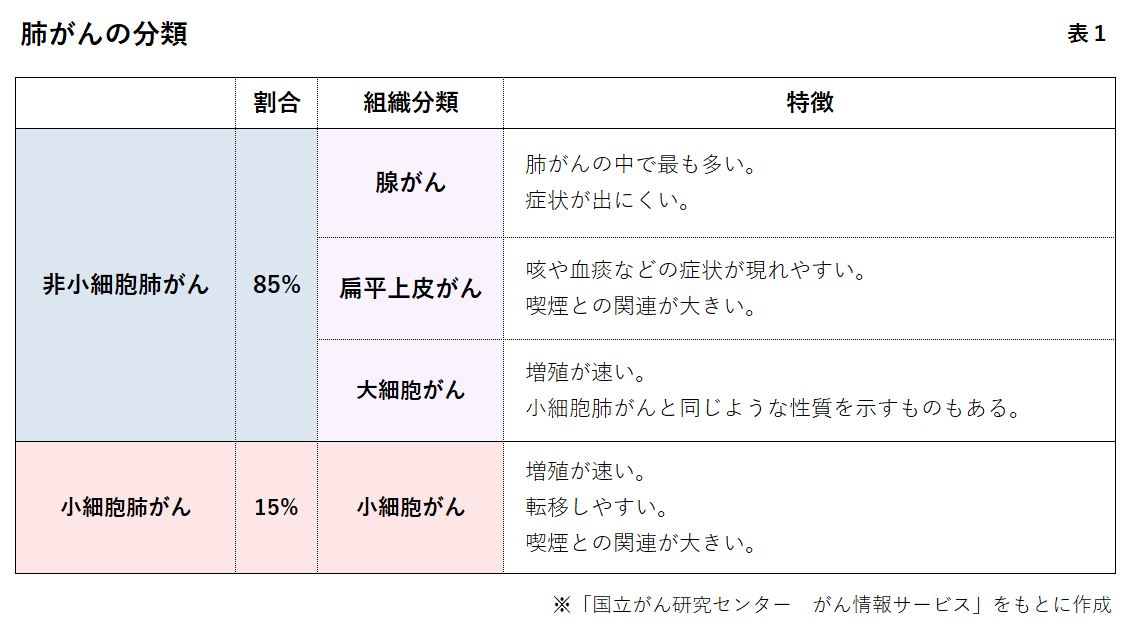
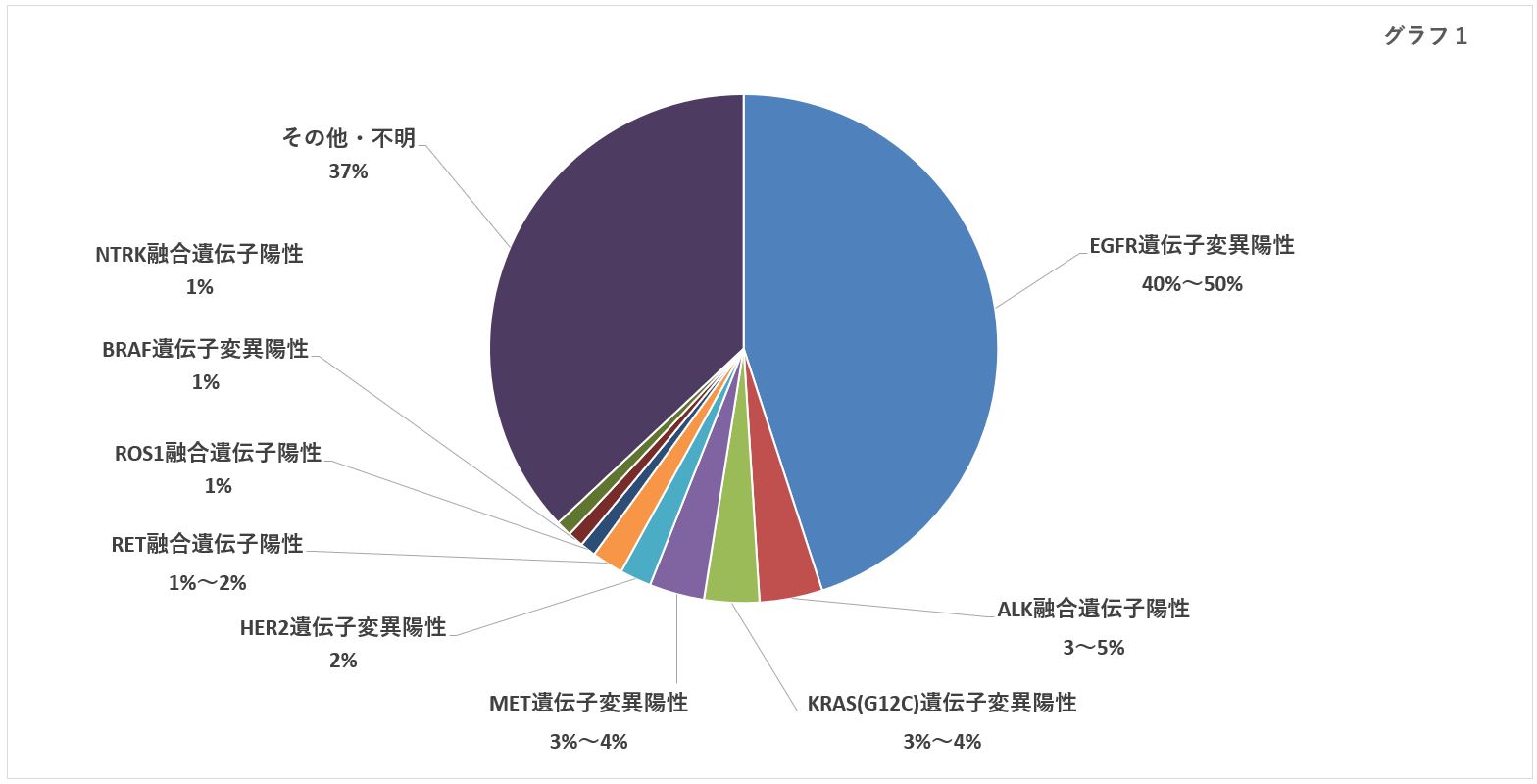
最も多い肺腺がんは、さらに細かい。ドライバー遺伝子を持っているかどうか、持っている場合はどんな種類かによって分類される(円グラフ参照)。ドライバー遺伝子とは、正常な遺伝子が変化して、がんを増殖させるスイッチが入ったもの。ドライバー遺伝子を攻撃する分子標的薬があれば、まずは分子標的薬で治療するのが基本だ。
冒頭の「5年生存率75%」は、ALK融合遺伝子というドライバー遺伝子を持つタイプのがんだ。ドライバー遺伝子を持つことを「陽性」と呼ぶため、ALK融合遺伝子陽性の肺腺がんとなる。非小細胞肺がんの遺伝子変異のうち、3~5%を占める。
ALK融合遺伝子は2007年、間野博行氏(現国立がん研究センター研究所長)らによって発見された。2012年に最初の薬、ザーコリ(一般名クリゾチニブ)が承認され、2014年にはアレセンサ(アレクチニブ)が登場した。このアレセンサが高い効果を示し、「臨床試験の中で投与を開始してから8年間効いている患者がいる」と話す医師もいる。
 ※国立がん研究センター東病院の後藤功一先生への取材などから作成
※国立がん研究センター東病院の後藤功一先生への取材などから作成
分子標的薬はエース投手から使う

国立がん研究センター東病院の後藤功一先生(=同センター提供)
ちなみに薬には商品名(ブランド名)と一般名(有効成分名)がある。一般名でしか書かれていない解説もあるので、この記事では初出は「商品名(一般名)」、2回目以降は「商品名のみ」で表記する。
ドライバー遺伝子を持つ肺腺がんである非小細胞肺がんの最も多いタイプは、EGFR遺伝子変異陽性で、40~50%を占める。2002年に登場したイレッサ(ゲフィチニブ)を皮切りにいくつかの分子標的薬が生まれた。現在は、2016年に承認されたタグリッソ(オシメルチニブ)が主役だ。
従来の抗がん剤が正常細胞も攻撃してしまうのに対し、分子標的薬は主にがん細胞のみを攻撃するので、正常細胞へのダメージは比較的少ない。重い副作用が出ることもあるが、概して、副作用の負担は抗がん剤より軽い。薬を飲むだけで済み、入院もしない。
ただ、飲み続けるとがん細胞が薬に対する耐性を獲得するので、効かなくなれば次の薬へつなぐ。
分子標的薬は、複数あるならエース投手から起用していく。たとえばALKなら、アレセンサから使う。国立がん研究センター東病院の後藤功一・呼吸器内科長が言う。 「治療の最初からよく効く薬を使うのが基本です。そのほうが、患者さんのQOL(生活の質)も高く保てます。結果的に生存期間も延びるでしょう」
白地図が埋まるように分子標的薬が登場
ここ数年、EGFR、ALK以外のドライバー遺伝子に対する分子標的薬も登場している。
ROS1融合遺伝子陽性にはザーコリ、BRAF遺伝子変異陽性にはタフィンラー(ダブラフェニブ)とメキニスト(トラメチニブ)の併用療法、NTRK融合遺伝子陽性にはロズリートレク(エヌトレクチニブ)。いずれも患者数は1%程度だが、治療薬が承認された意義は大きい。
まだ薬が承認されていないドライバー遺伝子に対しても、研究開発は進んでいる。後藤功一先生が言う。 「2019年9月にスペインで開かれた世界肺癌学会で、開発中の有望な分子標的薬の発表がありました。KRAS遺伝子変異陽性(G12Cという特異的な変異は、3~4%)に対するAMG510、RET融合遺伝子陽性(1~2%)に対するロキソ292(LOXO-292)です。KRASに対する薬の開発はさらに2剤、3剤と進みそうです」
KRASは患者の数が多いのに、薬の開発が滞っていた。それだけに、注目を集める。
ほかに、MET遺伝子変異陽性、HER2遺伝子変異陽性に対する分子標的薬も研究されている。将来的に新たな薬が使える可能性もあるだけに、
「今後は、肺がんとわかったときに、すでに薬が承認されている5つの遺伝子に加えて、KRAS、RET、MET、HER2も加えた9つの遺伝子について調べておいたほうがよいでしょう」(後藤功一先生)という。
世界地図の白地図に訪れた国を少しずつ塗っていくように、分子標的薬が投入されてきた。今はまだ白い国にも、いずれ色が塗れるようになることを期待したい。
耐性化のメカニズムを見極め、製薬へ
先にも触れたが、分子標的薬には、耐性化をどう克服するかという課題が残る。
たとえばALK融合遺伝子陽性なら、アレセンサが効かなくなると、2018年に承認されたローブレナ(ロルラチニブ)を使うことが考えられるが、それも効かなくなった場合は、どうするか? その他の分子標的薬が再び効くという研究もあるが、単純ではなさそうだ。
後藤功一先生によると、耐性化を起こす仕組みは複数あるという。
「分子標的薬を飲んでいるうちに、がん細胞の性格は変わってきます。したがって、どんなメカニズム(機序)で耐性化したのかをつかむことが大切です。それがわかれば、薬は作れるでしょう。最近は製薬にかかる時間も数年ぐらいに短縮してきました。なぜ効かなくなったかを見極めるため、もう一度組織を採取して遺伝子解析をすることが重要です」
とすれば、今後も、耐性化に対応した分子標的薬が登場する可能性はある。
オプジーボに続け!
一方で、気になるのはやはり、免疫療法である。
従来の抗がん剤や分子標的薬ががん細胞そのものを標的にするのに対し、免疫療法では、直接、がん細胞は叩かない。少し長くなるが、大まかな仕組みはこうだ。
人間の体には、細菌やウイルスなどの“非自己”(異物) の侵入を防いだり、侵入してきたら排除したりする免疫システムがある。がん細胞は、遺伝子変異の結果、生じている。免疫システムは、この遺伝子変異の産物を“非自己”とみなして攻撃できる。
一方、強すぎる免疫反応は自分の臓器や細胞を攻撃してしまい、アレルギー疾患やリウマチなどの自己免疫疾患を引き起こしかねない。
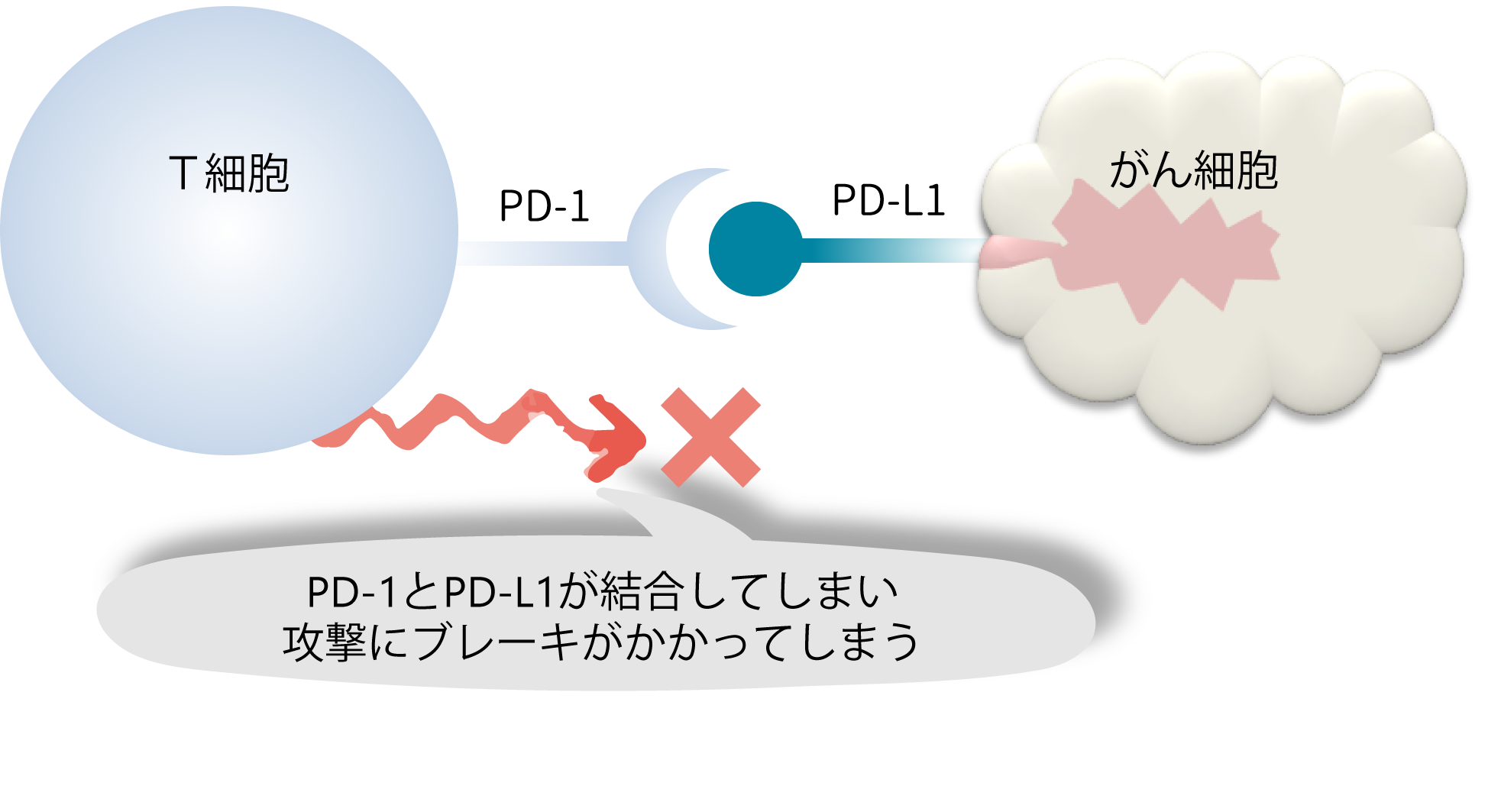
そこで、免疫システムは、免疫反応を抑制する機能も備えている。“非自己”を攻撃する免疫細胞(キラーT細胞)は、自身の表面に免疫チェックポイント分子(PD-1分子)を出す。このPD-1分子は、免疫システムにおけるブレーキペダルのようなものだ。
ただし、単独では何もしない。PD-L1分子という“相棒”と結合して初めて、免疫反応を抑制する。がん細胞や抗原提示細胞(侵入した“非自己”の情報を伝達する細胞) はPD-L1分子を発現させて、PD-1分子と結合することで、「免疫を弱めろ 」というメッセージをキラーT細胞に送るのだ(図参照)。
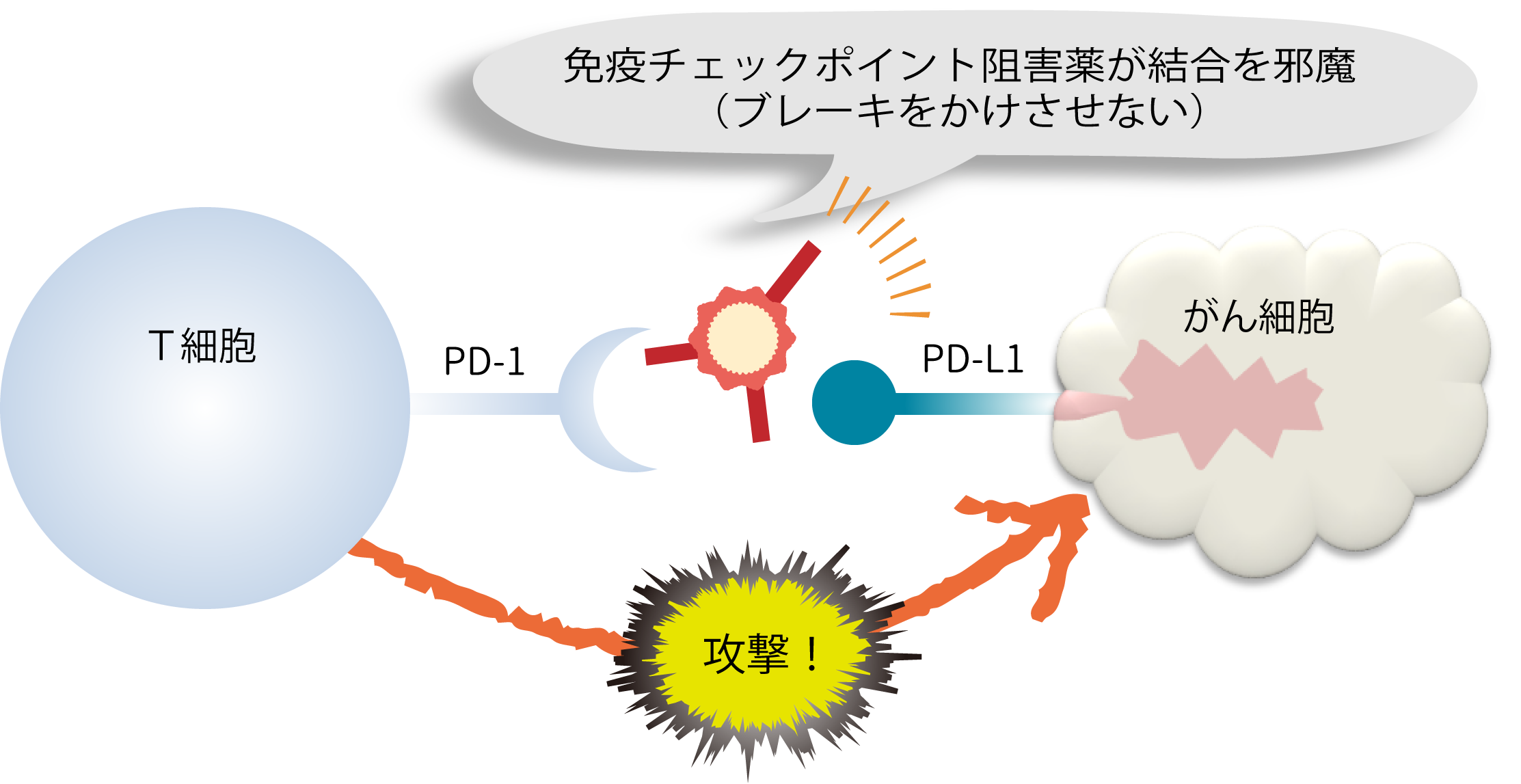
この仕組みに目を付けたのが免疫チェックポイント阻害薬だ。PD-1分子とPD-L1分子がくっつくのを邪魔する(=阻害する)ことで、がん細胞にブレーキペダルを踏ませない。そして、活性化したキラーT細胞が、がん細胞を叩く。
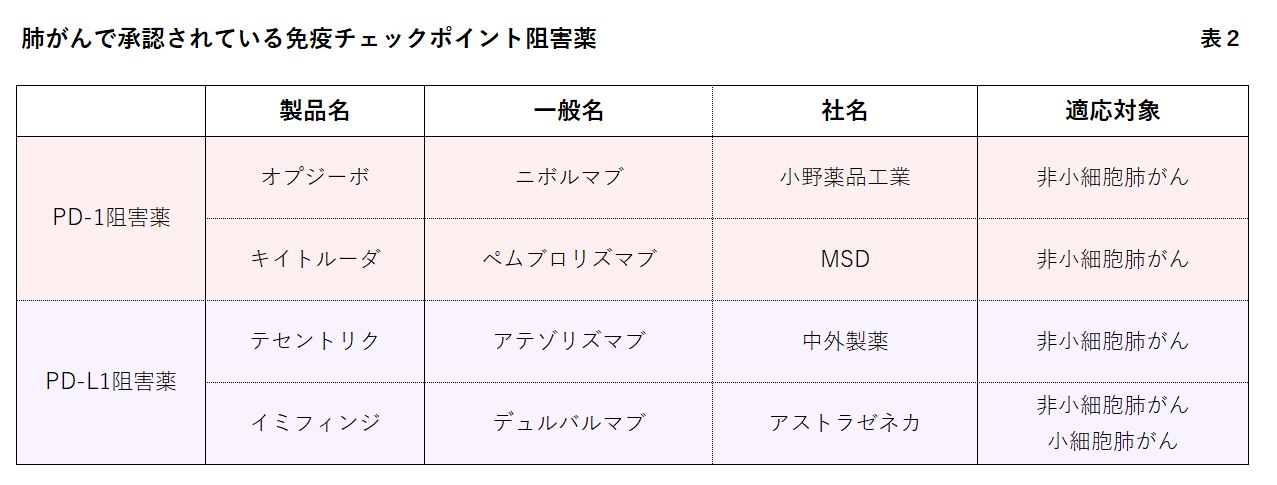
現在、肺がんで承認されている免疫チェックポイント阻害薬は、先頭ランナーのオプジーボ(ニボルマブ)に続き、キイトルーダ(ペムブロリズマブ)、テセントリク(アテゾリズマブ)、イミフィンジ(デュルバルマブ)も登場して、4種類ある。厳密には薬によって作用機序(仕組み)が違うが、効き目はほぼ同じだという(表2参照)。
免疫療法が広げる“治癒”の世界

順天堂大学大学院の高橋和久先生
「免疫療法では、分子標的薬のように耐性化が起きません。オプジーボが効く人は非小細胞肺がんの患者さんの15~20%ぐらいですが、この人たちは治癒したようにずっと効いています。この“治癒類似状態”に至る確率を向上させることが、免疫療法の目的です」
高橋先生が期待するのは、併用療法だ。免疫チェックポイント阻害薬同士、あるいは免疫チェックポイント阻害薬と別の薬を組み合わせて使うことで、治療効果を高める。
「たとえば、オプジーボとヤーボイ(CTLA-4というPD-1とは別の免疫チェックポイント分子に対する薬)を組み合わせると、オプジーボ単独よりもはるかに効果が高い。メラノーマ(悪性黒色腫)では、この組み合わせで、“治癒類似状態”に至る確率30%ぐらいを実現しています」高橋先生は、放射線との併用療法にも期待を寄せる。 「放射線と免疫療法は、とても相性がいいのです。放射線治療によってがん細胞が死ぬ際に、体内の免疫反応が活性化されます。その結果、免疫チェックポイント阻害薬がより効果を発揮するとみられます」
ただし、併用療法には副作用が強くなるというマイナス要素もある。免疫チェックポイント阻害薬は免疫を活性化させるため、皮膚の湿疹、下痢、間質性肺炎、自己免疫性の腸炎や膵炎などの副作用がある。そのため、効果と副作用の見極めが重要になる。
まだある免疫チェックポイント分子
現在、同じ免疫チェックポイント阻害薬でも、キイトルーダは1次治療(最初の治療。ファーストラインともいう)から使えるが、オプジーボは2次治療以降でないと使えない。
長年免疫療法に取り組んできた埼玉医科大学国際医療センターの各務博教授は、 「さまざまな臨床試験から考えると、PD-1阻害薬のみならず免疫チェックポイント阻害薬を1次治療から適切に使用すれば、“治癒類似状態”に至る確率が30%ぐらいに上がるのではないでしょうか」 とみる。ただ、免疫の仕組みは完全に解明できているわけではない。
たとえば、免疫チェックポイント阻害薬は、がん細胞にPD-L1分子をたくさん発現させた人ほど効果が高そうだが、現実には、たくさん発現していても効かない人がいる。その逆もある。免疫にブレーキがかかる理由は、PD-1とPD-L1の結合だけではないのだろう。
免疫チェックポイント分子は、わかっているだけでも、PD-1とCTLA-4以外にも、LAG-3をはじめ7、8種類あるという。それらが免疫抑制の原因というケースもあるかもしれない。
「PD-1やCTLA-4 のようなホームランはなかなか出ないと思う」(各務先生)というが、新たな免疫チェックポイント阻害薬が登場し、効果的な使い方がわかれば、“治癒類似状態”に至る人が増えるかもしれない。
免疫の仕組みのさらなる解明を

埼玉医大国際医療センターの各務博先生
兵士を増やすには、放射線によるアブスコパル効果(放射線照射により活性化したT細胞が増加し、照射した部位から離れた腫瘍が縮小する現象) が有効ではないか、とみる。
「将来的には、血液検査で免疫細胞の状況を調べて、放射線との併用療法か、免疫チェックポイント阻害薬を単独で使うかを選ぶ。そんな個別化医療も考えられます」
ところで、一般的には、分子標的薬が効くタイプのがんには、免疫療法は効きにくいといわれるが、各務先生によると、ALK陽性、EGFR陽性でも一定の確率で免疫チェックポイント阻害薬が奏効することは知られている。各務先生は、1度は試す価値があると考える。
「大事なのは、無治療の長期生存。現時点で、“治癒類似の長期生存”を実現できるとすれば、免疫療法です。そのためにも、免疫の仕組みの解明が重要です。臨床試験の結果では、免疫チェックポイント阻害薬の恩恵にあずかれないのは、進行期肺がんの患者さんの約半数であると考えられます。逆に言えば、残りの半数の患者さんは、免疫状態に合わせた治療を行うことで、“治癒類似状態”に持ち込める可能性が見えてきたのではないでしょうか」
各務先生は希望も込めて、そう語った。小細胞肺がんでも免疫療法が適応に
肺がん治療で、なかなか目覚ましい成果が発表されないのが、小細胞肺がんだ。肺がんの約15%を占めるが、細胞分裂の速度が速く、難敵である。ただし、抗がん剤がよく効く。
2019年8月、小細胞肺がんで、免疫チェックポイント阻害薬のテセントリク、抗がん剤(カルボプラチン、エトポシド)の併用療法が承認された。各務先生が言う。
「この療法は、抗がん剤でがん細胞の足を止めておきながら、免疫療法の効果が出るのを待つものです。免疫チェックポイント阻害薬による制御が完全に不可能とは思えません」
さらに広い視点から、国立がん研究センター東病院の後藤功一先生はこう語る。 「小細胞肺がんでも、免疫療法、がんを増殖させるドライバー遺伝子の両者に関する基礎研究は進んでいます。いずれブレイクスルーになるような薬が出てくる可能性はあります」
デコボコだけど、確実に山を登っている
後藤功一先生はまた、究極のブレイクスルーは、併用療法ではなく、単独の薬にあるとみている。
「がん治療の歴史を振り返ると、治療効果が抜群に改善したのは単独の薬なのです。併用療法は、上乗せ効果。過渡的に活用する意味はありますが、同時に、基礎研究をしっかり進めて、今とは違う新しい作用機序の薬の開発に取り組んでいくことが不可欠です」
肺がんとわかったら、遺伝子を解析して、分子標的薬か免疫療法かを選択し、それぞれに合う薬を使う。冒頭でALK陽性5年生存率75%を提示した国立がん研究センター中央病院の後藤悌先生は、肺がんが手強い相手であることを前提としたうえで、こう語った。
「かつては手術ができない肺がんの患者さんが5年生きることは奇跡でした。10年前にも、治療は頭打ちになるのでは、という意見がありました。しかし、開発も研究もデコボコだけど、確実に階段を上っています」
視界が悪い山道を歩いている最中には、どこまで登ったかもわからない。だが、見晴らしのよいところに出ると、いつの間にか高く登っていることに気づく。肺がん治療も、そんなふうに進んでいるのだろう。




 村本 高史の「がんを越え、”働く”を見つめる」第23回 改めて考える「対話」の重要性
村本 高史の「がんを越え、”働く”を見つめる」第23回 改めて考える「対話」の重要性 2025年度「がんアドボケート活動助成事業」助成対象の3つの活動が決定
2025年度「がんアドボケート活動助成事業」助成対象の3つの活動が決定 クリコ流ふわふわ介護ごはん第40回 春めく3月♪ 軽やかに新生活をスタート
クリコ流ふわふわ介護ごはん第40回 春めく3月♪ 軽やかに新生活をスタート




